Para validar la utilidad clínica de realizar el análisis de ploidías embrionarias en biopsias embrionarias en tratamientos de Fecundación In Vitro (FIV), recientemente se ha llevado a cabo un estudio en el que participan expertos del Grupo Vitrolife.
A través de la investigación que analizó 1982 embriones de fertilización normal – presencia de 2 pronúcleos (PN) – y 380 con fertilización anormal (0PN, 1PN, 2.1PN y 3PN), se revelaron datos significativos sobre las tasas de correlación esperadas de la configuración de pronúcleos (PN) y el estado de ploidía embrionaria, agregando nuevos conocimientos gracias al uso de PGT-A Plus y la incubadora time-lapse EmbryoScope.
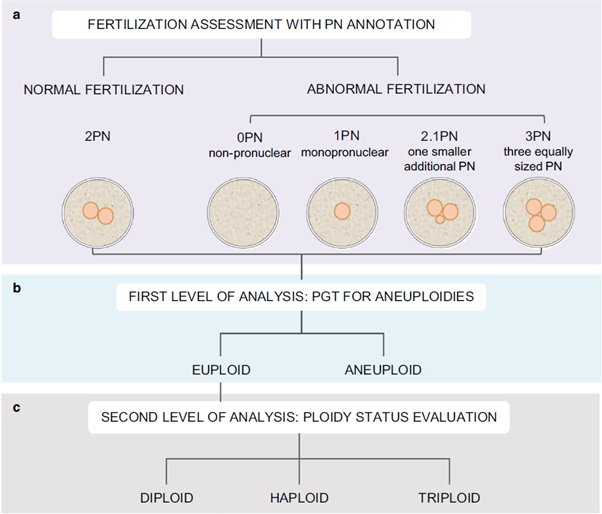
La evaluación del estado de ploidía embrionaria permite la detección de estas anomalías a nivel preimplantacional, proporcionando una opción de selección antes de la transferencia embrionaria, lo que podría disminuir la tasa de abortos espontáneos y mejorar los resultados generales del tratamiento de reproducción asistida. Además, la verificación de la ploidía molecular puede ser beneficiosa para proporcionar la oportunidad de rescatar algunas categorías de embriones pronucleados atípicos, en particular 0PN, 1PN y 2.1.
¿Cómo se llevó a cabo el estudio?
El estudio tuvo como objetivo identificar la correlación entre el estado morfológico pronuclear y la configuración ploidía determinada genéticamente en embriones antes de la transferencia al útero utilizando el Smart PGT-A Plus con evaluación morfológica con y sin el uso de la incubadora time-lapse EmbryoScope.
Además de los cigotos normalmente fertilizados, se analizó uno de los conjuntos de datos más grandes de cigotos pronucleados atípicos, proporcionando una descripción completa de las tasas de ploidía anormales para cada categoría en relación con el número de PN. A diferencia de otros estudios, dos metodologías validadas de forma independiente respaldan los hallazgos (plataformas NGS y matriz de SNP dirigida), demostrando proporciones consistentes de anomalías de ploidía en categorías de PN anormales equivalentes.
¿Qué son las ploidías?
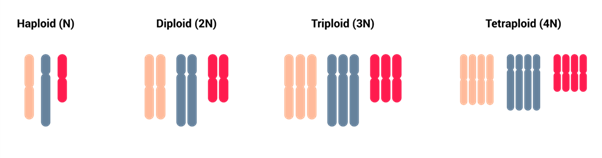
Las ploidías corresponden al número de conjuntos completos de cromosomas presentes en una célula u organismo. El número normal de conjunto de cromosomas que se esperan para un ser humano es de 2 copias, denominados diploides.
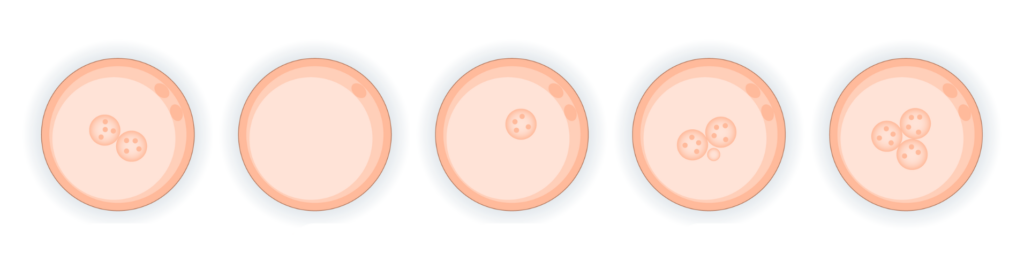
Un hecho que aumenta exponencialmente el riesgo de alteración de la ploidía es la fecundación anormal de un embrión, donde se observa un número de pronúcleos distinto a 2, que es el número compatible con un futuro embrión sano.
La práctica de excluir embriones con patrones anormales de NP en la FIV ha sido recomendada y justificada en base al aumento del riesgo de contribución genómica desequilibrada de los gametos, previsto exclusivamente por la PN. En la actualidad, el estudio genético Smart PGT-A Plus ha supuesto el avance para permitir la identificación de casos de triploidía, haploidía y diploidía y así aportar información sobre la posibilidad de transferencia embrionaria en estos casos.
¿Por qué euploide no significa diploide?
El término «diploide» describe la condición normal de las células, y el PGT-A confirma si el embrión ha alcanzado esta condición normal en términos de número de cromosomas, sin embargo, el PGT-A clásico normalizará el resultado de diploidía, triploidía y haploidía, porque no diferencia conjuntos completos de cromosomas. Solo el estudio PGT-A Plus tiene la capacidad tecnológica para diferenciar ploidias embrionarias en embriones clasificados inicialmente como euploides.
- El diploide es la «receta estándar» de los cromosomas para las células de nuestro cuerpo.
- Euploide es cuando el embrión sigue esta «receta estándar» y tiene el número correcto de cromosomas (que es el estado diploide).
La prueba genética PGT-A tiene como objetivo identificar si el embrión tiene un número incorrecto de cromosomas (aneuploide), lo que puede provocar fallos de implantación, abortos espontáneos o síndromes genéticos. Si el embrión tiene el número correcto de cromosomas (el estado diploide normal), el resultado del PGT-A es euploide.
Entienda la diferencia del PGT-A y PGT-A Plus
¿Cuál es el riesgo de que un embrión con fecundación normal presente una alteración de ploidía?
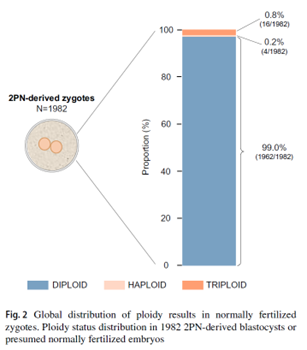
Según los datos de la investigación realizada, el riesgo de que los embriones con fecundación normal comprobados a través de la visualización de 2 PN no sean diploides es del 1%.
Correlación entre el número de pronúcleos y los resultados de ploidía
La aplicación de una evaluación molecular para complementar las evaluaciones morfológicas de la fertilización puede reducir potencialmente la tasa de clasificación errónea de ploidía cuando se observan patrones atípicos de PN asumidos, independientemente de su estado de fertilización, se ha revelado que muchos cigotos derivados de ovocitos (AFO) anormalmente fertilizados forman blastocistos de alta calidad [3-5].
Esta investigación analizó cuándo estos blastocistos pueden exhibir una composición genética diploide [3, 6, 7] e incluso pueden resultar en embarazos saludables [5, 8, 9]. Es importante señalar que la mayoría de los estudios previos no han sido respaldados por el uso de sistemas de lapso de tiempo, por lo tanto, la baja concordancia entre el número de PN y la constitución de ploidía también puede explicarse por la clasificación incorrecta.
Del mismo modo, estudios previos han demostrado que la presencia de 2PN no garantiza una composición diploide normal, reportando entre el 1 y el 2% de resultados no diploides en la fase preimplantacional [2, 9-13]. Estos estudios ponen de manifiesto una limitación de la evaluación microscópica estándar para predecir con precisión el estado de ploidía embrionaria a partir de los patrones de PN [8, 14, 15] y sugieren la necesidad de incorporar metodologías genéticas de alta precisión capaces de detectar cambios en la ploidía en la práctica clínica.
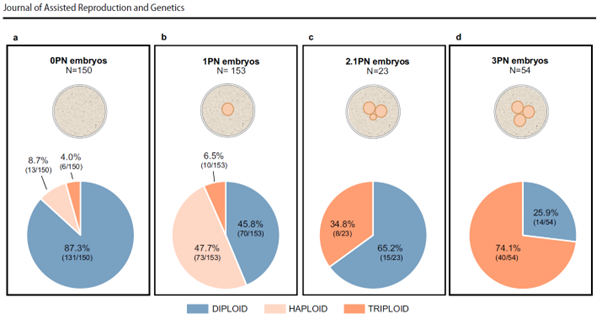
Fig. 4 Distribución global de configuraciones de ploidía en cigotos anormalmente fertilizados con diferentes estados pronucleares. Resumen de la distribución de los resultados de ploidía (diploide, haploide y triploide) reportados para cada grupo de embriones en relación con el número de pronúcleos (NP) detectados.
La ploidia da como resultado embriones derivados de a 0PN, embriones derivados de b 1PN, embriones derivados de c 2.1PN y embriones derivados de d 3PN
Impacto del cultivo del EmbryoScope en la correlación con los resultados de ploidía
El uso de time-lapse proporciona una mayor previsibilidad del estado de ploidía con respecto al estado pronuclear. Después de obtener los resultados esperados de la ploidía global en un entorno típico de FIV, donde se adopta tanto la observación convencional como la de lapso de tiempo, destacamos cómo las incubadoras time-lapse pueden influir en la evaluación de la fertilización y la correlación de ploidía mediante la evaluación de un pequeño subconjunto de embriones derivados de AFO, donde la ayuda del EmbryoScope confirmó la visualización de PN.
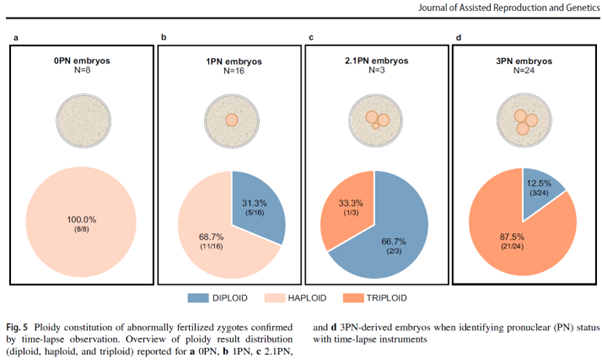
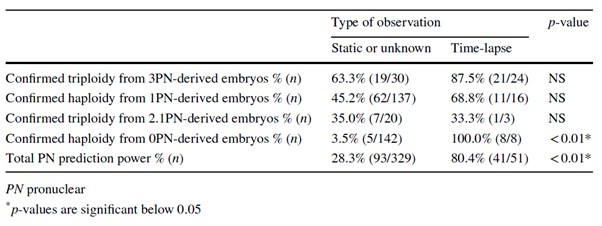
Tabla 1: Predictibilidad de la ploidía para el estado pronuclear según el tipo de observación de NP
En conjunto, los resultados proporcionan evidencia de apoyo para incorporar un enfoque molecular adicional en el flujo de trabajo estándar de PGT-A, complementando la verificación de la fertilización convencional para confirmar el estado de ploidía del embrión.
Esta estrategia puede mejorar los resultados clínicos de los embriones euploides 2PN al deseleccionar los resultados no diploides y evitar resultados desfavorables relacionados con los embarazos triploides y haploides.
Por otro lado, la mayor correlación entre el estado de ploidía y el número de PCV reportados con el time-lapse sugiere un menor beneficio de la prueba de ploidía confinada a una proporción mínima de cigotos diploides en las categorías 1PN y 2.1PN, donde persisten los resultados diploides. A pesar de esto, categorías específicas de pacientes pueden beneficiarse de las pruebas moleculares de embriones fertilizados anormalmente, como aquellos que sufren una disminución de la disponibilidad embrionaria, incluidos los pacientes con mal pronóstico o las parejas con condiciones monogénicas, y en general cuando no hay embriones euploides/diploides o no afectados disponibles.
Smart PGT-A Plus más allá de las ploidías
Definitivamente la posibilidad de evaluación ploidal es el beneficio más comentado del Smart PGT-A Plus, pero no es el único. Gracias a la tecnología que combina NGS + SNPs, la clínica de reproducción asistida añade dos importantes controles de calidad:
– Detección de contaminación de ADN de células externas y maternas en la muestra de células biopsiadas, lo que aumenta la seguridad sobre una fuente de riesgo de diagnóstico erróneo.
– El control de la correspondencia (entre embriones) es una herramienta de calidad que demuestra que el grupo de embriones analizados de una familia están genéticamente relacionados entre sí, proporcionando un control adicional del riesgo de intercambio de muestras por error humano.
Limitaciones del estudio
En cuanto a las principales limitaciones de este estudio, algunas formas raras de anomalías de ploidía no se pueden distinguir sin una muestra de análisis parental, como la disomía uniparental, cuando se heredan dos conjuntos de cromosomas diferentes de uno de los padres. Del mismo modo, las condiciones poliploides extremadamente raras en las que están presentes varios conjuntos de cromosomas idénticos no pueden distinguirse de la diploidía o del haplotipado de todo el genoma. Además, otra limitación potencial de las pruebas de ploidía está representada por un raro fenómeno biológico llamado mixoploidía o mosaicismo ploide [53, 54]. Se ha informado que la segregación aberrante de un genoma parental completo en distintas líneas celulares durante las divisiones cigóticas («división heterogónica») puede resultar en una mezcla de células con diferentes constituciones de ploidía en el embrión (por ejemplo, mixoploidía diploide / triploide) [53, 55].

Catherine Kuhn Jacobs, Embriologa y Soporte Clínico Vitrolife Group
Girardi, L., Patassini, C., Miravet Valenciano, J. et al. Incidencia de haploidía y triploidía en biopsias de trofoectodermo de blastocistos derivados de ovocitos fertilizados normal y anormalmente. J Assist Reprod Genet 41, 3357–3370 (2024).